کوکسیدیوز
به منظور پیشگیری و درمان بیماری کوکسیدیوز در طیور به ویژه جوجههای گوشتی، راهکارهای متفاوتی مورد توجه و استفاده قرار گرفته است که دو روش استفاده از دارو و واکسیناسیون از جمله موفق ترین روشها است. داروی متعددی در پیشگیری و درمان دامپزشکی بیماری کوکسیدیوز در انواع طیور مورد استفاده قرار میگیرد که در ادامه تلاش شده است تا داروهای رایج در درمان و پیشگیری از کوکسیدیوز مورد اشاره قرار گیرد.
مبجث پیشگیری از کوکسیدیوز در مرغ به وسیله داروهای مخلوط در دان (پروفیلاکسیس) برای اولین بار در سال ۱۹۴۸ و با استفاده از سولفاکوئینوکسالین به عنوان اولین افزودنی خوراک طیور مطرح شد و طی سالیان بعد با رواج مصرف داروهای یونوفره و سنتتیک توسعه یافت. با این همه طی دهههای اخیر ترکیب ضد کوکسیدیوز جدید برای استفاده در صنعت طیور کشف نشده است که موجب گزارشهای متعدد از بروز مقاومت به داروهای درمان کوکسیدیوز شده است. گونههای متفاوت انگل ایمریا و نحوه رشد و نمو آنها در بدن طیور به طور اختصاصی در مطلب کوکسیدیوز در طیور مورد بررسی قرار گرفته است و این تفاوت میتواند بر نحوه پاسخ به داروی کوکسیدیوستات موثر باشد.
داروهای کوکسیدیوز در طیور را می٬توان در دو دسته کلی طبقه بندی کرد:
- آنتی بیوتیکهای پلی اتر یا یونوفرهها: این داروها طی فرآیند نخمیر با استفاده از قارچهای خانوادههای استرپتومایسس یا آکتینوباکتر تولید میشوند و موجب اختلال در تعادل یونی در دو طرف غشا سلول انگل میشوند.
- یونوفره تک ظرفیتی مانند موننسین، ناراسین و سالینومایسین
- یونوفره تک ظرفیتی گلیکوزیدی: مادورامایسین و سمدورامایسین
- یونوفره دو ظرفیتی: لازالوسید
- ترکیبات شیمیایی: این ترکیبات طی فرآیندی صنعتی ساخته میشوند و بر اساس ساز و کار کنترل کوکسیدیوز طبقه بندی میشوند.
- جلوگیری از تنفس میتوکندری: دکوکوئینات و کلوپیدول
- جلوگیری از ساخت اسید فولیک: سولفانامیدها
- رقابت با تیامین در جذب: آمپرولیوم
- ساز و کار ناشناخته: روبنیدین، دیکلازوریل، هالوفوگینون و نیکاربازین
داروهای کنترل کوکسیدیوز به شکل ترکیبی در قالب نامهای تجاری نیز به بازار ارائه شدهاند. این داروها اغلب ترکیبی از یک کوکسیدیوستات شیمیایی و یک داروی یونوفره (به عنوان مثال، محصول مکسیبان شرکت الانکو که ترکیبی از نیکاربازین و ناراسین است) یا ترکیبی از دو کوکسیدیوستات شیمیایی (محصول لربک شرکت ایمپکس تراکو ان وی که ترکیبی از کلوپیدول و متیل بنزوکوئینات است) هستند. در گدشته استفاده از داروهای حاوی آرسنیک از جمله روکسارسون و مشتقات اسید آرسانیلیک و کربارسون در کنترل کوکسیدیوز متداول بود که پس از محرز شدن امکان تبدیل شکل آلی آرسنیک به نوع غیرآلی و بسیار سمی، مصرف این ترکیبات در بسیاری از کشورها ممنوع شد.
یونوفرههای پلی اتر
آنتی بیوتیکهای یونوفره برای اولین مرتبه در سال ۱۹۵۱ با جداسازی دو ترکیب نیجریسین (Nigericin) و اسید لازالوسید (Lasalocid Acid) از قارچ استرپتومایسس شناسایی شدند و نام یونوفره در سال ۱۹۶۷ برای آنها استفاده شد. از آن تاریخ تاکنون بیش از ۵۰ میکرواورگانیسم با قابلیت تولید ترکیبات یونوفره و بیش از ۱۲۰ ترکیب متعلق به این خانواده شناسایی شده است. یونوفرهها ملکولهایی آلی با قابلیت اتصال به کاتیونهای فلزی و ایجاد کمپلکس محلول در چربی هستند که امکان عبور آنها از غشا سلول را تسهیل میکند. یونوفرهها همواره حاوی یک گروه کربوکسیل، حلقههای متعدد تتراهیدروپیران و تتراهیدروفیوران، گروههای متعدد هیدروکسیل و یک گروه کتون هستند و این گروهها نقش تعیین کننده در فرآیند ایجاد پیوند با کاتیون فلزی تک ظرفیتی (موننسین و سالینومایسین) و کاتیون فلزی دو ظرفیتی (لازالوسید) دارند. یونوفرههای تک ظرفیتی متمایل به تشکیل پیوند با یون سدیم و پتاسیم بوده و انواع دو ظرفیتی با کاتیون کلسیم و منیزیوم وارد پیوند میشوند.
ترکیبات یونوفره پس از کشف، برای سالیان طولانی تنها گزینه پیشگیری از کوکسیدیوز در طیور بودند اما به سبب اینکه این گروه دارویی قادر به نابودی کامل انگل کوکسیدیوز نیست، به تدریج علایم بروز مقاومت دارویی متعاقب مصرف کوکسیدیوستاتهای یونوفره در مزارع پرورش و نگهداری طیور گزارش شد.
همان طور که پیش از این اشاره شد، یونوفرهها ترکیباتی هستند که قادر به تشکیل پیوند با یونها به ویژه سدیم و پتاسیم و انتقال آنها از غشا زیستی بوده و غلظت یون سدیم را در داخل سلول افزایش میدهند. متعاقب این عمل تعادل یونی در دو طرف غشا سلولی انگل بر هم خورده و با ادامه آن و جذب آب، در نهایت انگل میترکد. داروهای یونوفره بسته به نوع آنها، تمایل متفاوتی به ایجاد پیوند با کاتیونها دارند. این گروه از ترکیبات کوکسیدیوستات از محصولات تخمیری استرپتومایسس و دیگر گونه های قارچی به دست میآیند. یونوفرههای رایج در صنعت طیور شامل سالینومایسین، مادورامایسین، لازالوسید، موننسین، ناراسین، لیدلومایسین (Laidlomycin) و سمدورامایسین (Semduramycin) هستند که در بین آنها موننسین به دلیل نداشتن اثرات منفی روی حیوان و عملکرد مطلوب روی کنترل انواع گونههای کوکسیدیوز، در مقایسه با دیگر انواع رواج بیشتری در سطح جهان داشته است. از آنتی بیوتیکهای یونوفره به عنوان محرک رشد در دام استفاده میشود اما تاکنون در پزشکی به کار گرفته نشدهاند. لازم به توضیح است که ترکیبات یونوفره بر باکتریهای آلوده کننده خوراک طیور از جمله اشرشیاکلی، سالمونلا و کمپیلوباکتر بیتاثیر هستند.
حد مسمومیت ترکیبات یونوفره اغلب نزدیک به دز مصرف پیشنهادی است و از طرفی بسیاری از آنها با برخی آنتی بیوتیکهای درمانی تداخل دارند. در مطالعات متعدد تداخل ترکیبات یونوفره با تیامولین، کلرامفنیکل، اریترومایسین، اولئاندرومایسین و تعدادی از سولفانامیدها گزارش شده است. همچنین یونوفرهها با برخی ترکیبات آنتی اکسیدان ناسازگار هستند. مسمومیت با ترکیبات یونوفره در گاو، اسب، سگ، گربه و پرندگان گزارش شده است. مسمومیت قلبی، تحلیل ماهیچهها و نوروپاتی به دلیل آسیب غشا میلین و آتاکسی از جمله نشانههای مسمومیت با ترکیبات یونوفره است.
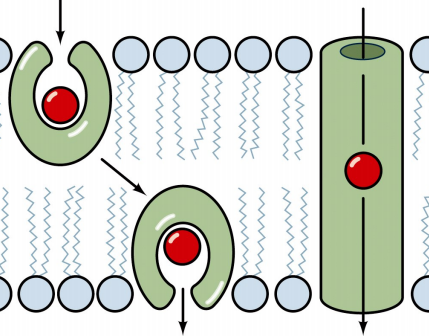
موننسین
موننسین محصول تخمیری استرپتومایسس سیناموننسین (Streptomyces cinnamonensis) بوده و پرمصرف ترین آنتی بیوتیک در کنترل کوکسیدیوز است که در سال ۱۹۶۷ کشف شد. مکانیسم اثر موننسین به صورت اختلال در نفوذ پذیری غشا سلولی ایمریا نسبت به یون سدیم و پتاسیم بوده و با افزایش غلظت سدیم درون سلولی موجب متلاشی شدن سلول انگل میشود. بیشترین اثرگذاری این ترکیب روی نسل اول شیزونت و تروفوزوئیت بوده و اوج عملکرد آن در دو روز اول چرخه حیات کوکسیدیوز است.
مونسین با مقدار ۰.۰۱ تا ۰.۱۲۱ درصد از خوراک قادر به محافظت علیه تمام انواع ایمریا میباشد. مصرف موننسین اغلب با بهبود عملکرد گله شامل وزن بدن و ضریب تبدیل غذایی همراه بوده و علاوه بر کوکسیدیوز، موجب کاهش درگیری با تورم نکروتیک روده میشود و طبق نتایج مطالعات در مقایسه با آمپرولیوم، کلوپیدول و زوآلن به نحو کارآمدتری کوکسیدیوز را کنترل میکند. طبق قوانین آمریکا، مصرف موننسین در جیره حداقل سه روز پیش از کشتار باید قطع شود و به طور کلی نباید در طیور در حال تخم گذاری مصرف شود.
مصرف این دارو همراه با کلرامفنیکل و اریترومایسین میتواند موجب مسمومیت شود و مصرف همزمان موننسین با تیامولین و اولئاندومایسین باعث میوپاتی، ضعف شدید و توقف رشد میشود. مواردی از کاهش رشد جوجه گوشتی به دنبال مصرف موننسین در فصل گرما گزارش شده است که با افزایش سطح پتاسیم جیره رفع میشود. برخی از مطالعات قدیمی به تداخل موننسین با متیونین و کاهش سرعت رشد اشاره شده که تاکنون ساز و کار مستندی در این ارتباط یافت نشده است. مسمومیت اسب با موننسین و مرگ در اثر آن به کرات گزارش شده است.
موننسین با کلرامفنیکل، فلورفنیکل، سولفانامیدها و اریترومایسین تداخل داشته و نباید به طور همزمان مصرف شود. موننسین همچنین به دلیل داشتن اثر ثانویه کاهش مصرف آب در گله، از گزینههای مطلوب برای فصل سرما به حساب میآید.
لازالوسید
لازالوسید ترکیب تخمیری دیگری است که از استرپتومایسس لازالینسیس (Streptomyces lasaliensis) به دست میآید و از فعالیت ضدکوکسیدیوزی قوی برخوردار است. دز موثر این دارو در خوراک معادل ۰.۰۰۵ تا ۰.۰۰۷۵ درصد است و همانند موننسین باعث بهبود ضریب تبدیل غذایی و وزن بدن در جوجه گوشتی میشود. لازالوسید علاوه بر یونهای تک ظرفیتی، روی انتقال کاتیونهای دو ظرفیتی در غشا سلول انگل کوکسیدیوز نیز موثر است و به همین دلیل تنها یونوفره دو ظرفیتی به حساب میآید. به کارگیری لازالوسید در خوراک جوجه گوشتی موجب بهبود عملکرد و سرعت رشد میشود.
لازالوسید با وجودی که از جمله کم خطرترین ترکیبات یونوفره برای طیور محسوب میشود، با کلرامفنیکل تداخل دارویی داشته و موجب نوعی مسمومیت عصبی در جوجه میشود که نخاع و عصب سیاتیک را درگیر میسازد. مصرف همزمان لازالوسید و تیامولین فاقد تاثیر منفی است.
استفاده از لازالوسید در خوراک مرغان مادر حتی به صورت اتفاقی موجب کاهش شدید تخمگذاری، باروری و جوجهدرآوری میشود. همچنین جوجههایی که از این مادران تفریخ میشوند، اغلب مبتلا به ناهماهنگی عضلانی، ضعف در ماهیچههای پا و فلجی هستند.
در برخی از منابع قدیمی، مصرف لازالوسید در زمان تنش گرمایی توصیه نشده است اما به نظر میرسد شواهد متقن در این ارتباط وجود ندارد.
سالینومایسین
این ترکیب از محیط کشت استرپتومایسس آلبوس (Streptomyces albus) استخراج می شود و از نظر ساختمانی و مکانیسم عمل شبیه موننسین است اما برخلاف موننسین، تمایل بسیار زیادی به کاتیون پتاسیم دارد و موجب تخلیه میتوکندری و سیتوپلاسم از یون پتاسیم میشود. دز رایج برای سالینومایسین ۰.۰۱ درصد بوده که در مطالعات از نظر خاصیت ضدکوکسیدیوزی معادل ۰.۰۱۲۱ درصد موننسین است. سالینومایسین علاوه بر انگل ایمریا، بر باکتریهای گرم مثبت به ویژه مایکوباکتریا و برخی قارچهای فیلامنتوس موثر است.
سالینومایسین در بوقلمون و طیور در حال تخم گذاری توصیه نمیشود و نیز از استفاده همزمان این دارو با تیامولین باید اجتناب کرد. حداقل فاصله زمانی بین قطع مصرف تیامولین تا زمان آغاز استفاده از سالینومایسین پنج روز است. سالینومایسین با کلرامفنیکل، فلورفنیکل و اریترومایسین تداخل داشته و نباید به طور همزمان مصرف شود. مصرف توام سالینومایسین با باسیتراسین متیلن دی سالیسیلات موجب تقویت اثر آنها میشود. با این همه، سالینومایسین کم خطرترین ترکیب یونوفره است.
به تازگی نتایج امیدبخش استفاده از سالینومایسین در درمان سرطان پستان و مغز استخوان و پیشگیری از متاستاز در موش به دست آمده است.
مادورامایسین
مادورامایسین که با نام یومامایسین (Yumamycin) نیز شناخته میشود، از قدرتمندترین کوکسیدیوستاتهای یونوفره پلی اتر بوده و در دز ۵ تا ۶ پیپیام از فعالیت و عملکرد مشابه با دیگر یونوفرهها برخوردار است. lین ترکیب برای اولین بار از باکتری آکتینومادورا یومانسیس (Actinomadura yumaensis) استحصال شد و از نظر ساختمانی در مقایسه با دیگر یونوفرهها، یک ملکول بزرگ هتروسایکل محسوب میشود که با وجود تمایل بیشتر به کاتیونهای فلزی تک ظرفیتی، اما با یون کلسیم و منیزیوم هم تشکیل پیوند میدهد. مادورامایسین به دلیل برقراری اتصال با یونهای سدیم و پتاسیم، غشا سلول انگل را نسبت به این کاتیونها نفوذناپذیر کرده و سوخت و ساز سلولی را مختل میسازد. بیشترین اثر مادورامایسین پیش از تولید مثل جنسی است و مانع از تکامل شیزونتها میشود.
مادورامایسین تنها در جوجه گوشتی کاربرد داشته و دیگر انواع طیور مانند مرغ مادر و تخم گذار تجاری استفاده نمیشود. مصرف این دارو حداقل پنج روز پیش از کشتار باید قطع شود. این دارو نیز همانند دیگر یونوفره ها بهتر است همراه با تیامولین مصرف نشود. این ترکیب در میان ترکیبات یونوفره، از بیشترین میزان سمیت برای حیوانات غیرهدف و انسان برخوردار است. مسمومیت با مادورامایسین موجب آسیب شدید قلب و عروق شده و همچنین باعث توقف تکثیر و تحریک مرگ سلولی در مایوبلاستها میشود.
سمدورامایسین
سمدورامایسین از آکتینومادورا رزروفا (Actinomadura roserufa) به دست میآید که علاوه بر آنکه به نحوی سودمند بر ایمریا موثر است، جوجه گوشتی نیز بدون بازخورد منفی آن را تحمل میکند.
ناراسین
ناراسین از قارچ استرپتومایسس اروفاسینس (Streptomyces aureofaciens) استحصال میشود. ناراسین به عنوان کوکسیدیوستات یونوفره تک ظرفیتی از نظر ساختمانی مشابه سالینومایسین بوده و تنها تفاوت آن یک گروه متیله مازاد است و به همین دلیل ۴اس-۴-متیل سالینومایسین هم نامیده میشود.
از مصرف ناراسین در طیور در حال تخم گذاری باید اجتناب شود و مصرف همزمان آن با تیامولین همچون موننسین موجب افت شدید رشد میشود. دوره پرهیز از ناراسین پنج روز است. ناراسین با کلرامفنیکل، فلورفنیکل، سولفاکینوکسالین و اریترومایسین تداخل داشته و نباید به طور همزمان مصرف شود. مسمومیت با دز بالای ناراسین موجب مرگ در خوک، ضعف ماهیچه پا و فلجی در بوقلمون و مشکلات قلبی در خرگوش شد.
ناراسین در کنار موننسین و نیکاربازین از پرمصرف ترین داروهای ضدکوکسیدیوز در آمریکا محسوب میشود. ترکیب ناراسین و دیکلازوریل از جمله داروهای تجاری موفق در کنترل کوکسیدیوز به حساب میآید. همچنین ترکیب ناراسین و نیکاربازین با نسبت یک به یک از جمله کمپلکسهای موفق درمان کوکسیدیوز در طیور است که تحت عنوان ماکسیبان (Maxiban) به بازار عرضه شده است..
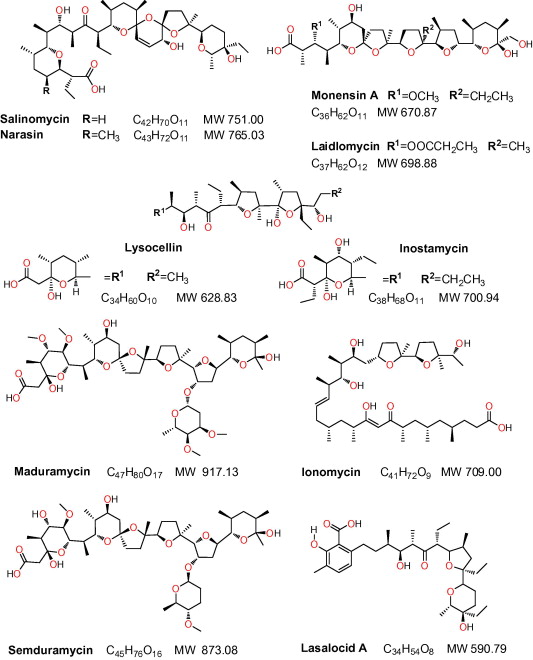
ترکیبات سنتتیک (شیمیایی)
این گروه از داروهای ضدکدکسیدیوز از نظر ساختار شیمیایی و مکانیسم اثر بسیار متنوع بوده و اغلب به طور مصنوعی در آزمایشگاه تولید میشوند. کوکسیدیوستاتهای سنتتیک از نظر ساختار ملکولی به چند گروه شامل فلورو کینولونها، پریدونها، آلکالوئیدها، گوانیدینها، آنالوگهای تیامین و مشتقات تری آزین دسته بندی میشوند. مهمترین کوکسیدیوستاتها از این گروه شامل سولفانامیدها، روبنیدین، نیکاربازین، دیکلازوریل، آمپرولیوم و اتوپابات هستند. مکانیسم اثر برخی از ترکیبات سنتتیک شناخته شده است اما برای برخی از این ترکیبات از جمله دیکلازوریل، نیکاربازین، هالوفوگینون و روبینیدین، این فرآیند ناشناخته است.
گروه بزرگی از ترکیبات کوکسیدیوستات شیمیایی به واسطه ایجاد اختلال در سنتز یا متابولیسم اسید فولیک، مانع از توسعه و تکامل انگل ایمریا میشوند. اغلب این کوکسیدیوستاتها از جمله سولفانامیدها، ۲،۴-دی آمینو پریمیدینها و اتوپابات به دلیل آنتاگونیست بودن با اسید فولیک و شباهت ساختمانی با پی آمینو اسید بنزوئیک (PABA) به عنوان پیشساز اسید فولیک، مانع از سنتز این ویتامین توسط انگل میشوند. همچنین تعدادی از ترکیبات شیمیایی مانند دیاوردین و اورمتوپریم (Ormetoprim) باعث اختلال در عملکرد طبیعی آنزیم دیهیدروفولات ردوکتاز میشوند. از آنجایی که گسترش کوکسیدیوز نیاز به تولید فراوان اسیدهای نوکلئیک دارد، نیاز اسید فولیک افزایش مییابد. این در حالی است که حیوان میزبان قادر به برداشت اسید فولیک موجود در خوراک بوده و نیازی به PABA ندارد.
جلوگیری از تنفس میتوکندریایی انگل به سبب تفاوت ساز و کار آن با نحوه عملکرد میتوکندری مهرهداران، هدف برخی از مهمترین کوکسیدیوستاتهای شیمیایی است. به عنوان مثال، اووسیت آیمریا تنلا به طور عمده از سوکسینات یا مالات به علاوه پیروات جهت مصرف اکسیژن استفاده میکند و از آنجایی که زنجیره تنفس انگل تا حد زیادی به روتنون و آموباربیتال مقاوم است، میتوان چنین برداشت کرد که NADH دهیدروژناز از اهمیت کمتر در مقایسه با سوکسینات دهیدروژناز برخوردار است. کلوپیدول و کینولونها به این طریق مانع از تنفس سلولی در مراحل اولیه تکامل ایمریا میشوند.
سولفانامیدها
سولفانامیدها به دلیل ویژگی ضدباکتریایی و ضدانگلی، کاربرد وسیعی در داروسازی دارند و از قدیمیترین داروهای ضد کوکسیدیوز محسوب میشوند که در ضمن اثر وسیع الطیفی بر باکتریهای گرم مثبت و منفی دارند. سولفاکوئینوکسالین (Sulfaquinoxaline)، سولفادیمیدین، سولفادیمتوکسین (Sulfadimethoxine)، سولفانیتران و سولفاگوئینیدین از جمله رایجترین انواع سولفانامیدها در درمان کوکسیدیوز هستند و از اثرات وسیعی روی انواع انگلهای عامل این بیماری برخوردار بوده و در زمان اپیدمی بیماری جزو بهترین انتخابها محسوب میشوند. نکته مهم در مورد ترکیبات سولفانامیدی، اثر ضعیف آنها در کنترل و درمان ایمریا تنلا است. اغلب سولفانامیدها در مقدار مصرف پایین سبب توقف نسل دوم تولید شیزونتهای ایمریا شده و در دزهای بالا علاوه بر این اثر موجب توقف تولید نسل اول شیزونت و تولید مثل جنسی ایمریا میشوند. ایمریا قادر به سنتز اسید فولیک (ویتامین B9) از پی آمینو اسید بنزوئیک (PABA) موجود در محیط برای متابولیسم سلولی است، این در حالی است که سولفانامیدها از نظر ساختمانی بسیار شبیه PABA بوده و با جایگزینی آن در سلول مانع تولید اسید فولیک میشوند. ماحصل این رخداد، توقف واکنشهای وابسته به اسید فولیک و مرگ تک یاخته است. سلولهای حیوان میزبان نیز وابسته به اسید فولیک است اما به دلیل دریافت مستقیم آن از خوراک و عدم سنتز سلولی آن، حضور سولفانامیدها فاقد تاثیر منفی معنیدار روی میزبان خواهد بود. اغلب توصیه بر این است که دی آمینو پریمیدین به دلیل ممانعت از تبدیل فولاسین به اسید تتراهیدروفولیک در کنار داروهای سولفانامیدی استفاده شود تا موجب تکمیل و تقویت اثر ضدکوکسیدیوزی آن گردد.

امروزه در اغلب کشورها از جمله اروپا، استفاده از داروهای سولفانامید در مهار کوکسیدیوز طیور به دلیل حضور ترکیبات باقیمانده در محصول ممنوع شده است. با این حال در آمریکا و تحت شرایط خاص در زمان درگیریهای شدید کوکسیدیوز میتوان از ترکیب سولفادیمتوکسین و اورمتوپریم در جوجه گوشتی استفاده کرد، مشروط بر آنکه دارو حداقل پنج روز پیش از کشتار حذف شود.
مهمترین داروهای سولفانامیدی در درمان کوکسیدیوز طیور به شرح زیر است:
سولفادیمیدین
این ترکیب در بسیاری از نقاط جهان کماکان به عنوان یک داروی موثر در زمان شیوع کوکسیدیوز استفاده میشود اما در آمریکای شمالی و اروپای غربی تقریبا به طور کامل با ترکیبات دیگر جایگزین شده است. دز مصرف سولفادیمیدین در خوراک ۰.۴ درصد و در آب آشامیدنی ۰.۲ درصد است و در موارد درگیری شدید کوکسیدیوز به خصوص ایمریا تنلا و نکاتریکس استفاده میشود. این دارو موجب توقف سنتز ویتامین K در روده شده و زمان انعقاد خون در حیوان میزبان را افزایش میدهد که از عوارض ناخواسته آن است. سولفادیمیدین در دزهای بالا باعث کاهش تولید تخم مرغ در مرغ تخم گذار شده و همچنین موجب هایپرپلازی لولههای سمی نیفر در بیضه خروس میشود.
سولفاکوئینوکسالین
سولفاکوئینوکسالینها متداول ترین، پرمصرف ترین و از موثرترین داروهای سولفانامیدی در کنترل کوکسیدیوز محسوب می شود. دز درمانی و پیشگیری سولفاکوئینوکسالین برای کوکسیدیوز به ترتیب معادل ۰.۵ و ۰.۰۳ درصد خوراک است. این دارو همچنین با دز ۰.۰۴۳ درصد در دو بازه زمانی دو روزه با فاصله سه تا پنج روز برای درمان کوکسیدیوز استفاده می شود. بیشترین اثر سولفاکوئینوکسالین روی مرحله شیزوگونی است. مصرف طولانی این دارو با دز بالا اغلب موجب عوارض نامطلوب شدید شامل خونریزی در اندام های داخلی به ویژه طحال، هایپوپلازی مغز استخوان و آرگانولوزیس در پرنده میزبان می شود که به طور عمده ناشی از کمبود ویتامین K است.
سولفاکوئینوکسالین طبق استاندارد حداقل شش روز پیش از کشتار باید حذف شود و تخم مرغ تولید شده در زمان استفاده از آن نباید به مصرف انسان برسد.
سولفادیمتوکسین
این دارو تنها داروی مورد تایید برای درمان کوکسیدیوز در سگ و گربه است و به ندرت در طیور مصرف می شود.
فلورو کینولونها
ترکیبات کینولون برای اولین بار در سال ۱۹۶۲ کشف شد و پس از آن با اعمال تغییرات زیادی در ساختار شیمیایی آن، تلاش شد تا ویژگیهای فارماکوکنیتیک آن ارتقا داده شود. ترکیبات کینولون به طور کلی ترکیبات باکتریوسید وسیع الطیفی با وجه اشتراک یک ملکول دو حلقهای (بایسیکلیک) متصل به گروه ۴-کینولون هستند که در صنعت داروسازی کاربرد زیادی دارند. تمام آنتی بیوتیکهای کینولون رایج فلوروکینولون بوده و به عبارتی واجد یک اتم فلوئور در ساختار شیمیایی خود هستند. تاکنون بیش از صدها نوع از کینولونها سنتز شده که تعدادی از آنها واجد اثرات ضدانگلی هستند. باکینولات، دکوئینات و نکوئینات کینولونهایی هستند که اثر ضدکوکسیدیوزی آنها در طیور و به ویژه مرغ تایید شده است. این گروه از کوکسیدیوستاتها در آب محلول نبوده و به همین دلیل جذب بسیار پایینی از طریق روده دارند و در بافتهای پرنده میزبان مجتمع نمیشود. کبد تنها بافتی است که کینولونها به مقدار بسیار اندک در آن ذخیره میشوند. این ترکیبات روی مرحله اسپروزوئیت و اوایل تروفوزوئیت موثر بوده و با وجودی که اسپور قابلیت نفوذ خود به درون سلول روده میزبان را حفظ میکند اما قادر به ادامه حیات نیست. بیشترین اثر این دارو روی بیست و چهار ساعت اول چرخه حیات کوکسیدیوز بوده و بنابراین مصرف آن هنگامی موثر خواهد که پیش از درگیری از آن استفاده شود. کینولونها به طور عمده سبب اختلال در تنفس سلولی و انتقال الکترون در سیتوکروم میتوکندری کوکسیدیا میشود و از این طریق عمل میکند.
دکوکوئینات
دکوکوئینات (۶-اتیل-۷-اتوکسی-۴-هیدروکسی-۳-کینولین کربوکسیلات) (Decoquinate) که در سال ۱۹۶۷ کشف شد، موجب جلوگیری از انتقال الکترون و تنفس در میتوکندری انگل ایمریا شده و به این ترتیب مانع از تکامل آن میشود. با این حال تاثیر دکوکوئینات در درمان شیوع کوکسیدیوز در طیور مورد تردید است زیرا به نظر میرسد قادر به نابودی کامل اووسیت ایمریا در پرندگان نیست. این مشکل دکوکوئینات سبب شده به دلیل احتمال ایجاد سویههای مقاوم، مصرف آن در درمان کوکسیدیوز طیور به شدت محدود شود. مصرف دکوکوئینات در کنار کلوپیدول موجب هم افزایی قابل توجه تاثیر آنها در کنترل کوکسیدیوز میشود. این دارو نسبت به دمای پلت کردن حساس بوده و تخریب میشود. امروزه استفاده از این ترکیب شیمیایی (با یا بدون کلوپیدول) در طیور به دلیل بروز سریع مقاومت دارویی به شدت محدود شده است.
دکوکوئینات به طور گسترده در درمان برخی عفونتهای باکتریایی در سگ و گربه از جمله میوزیت کاربرد دارد.
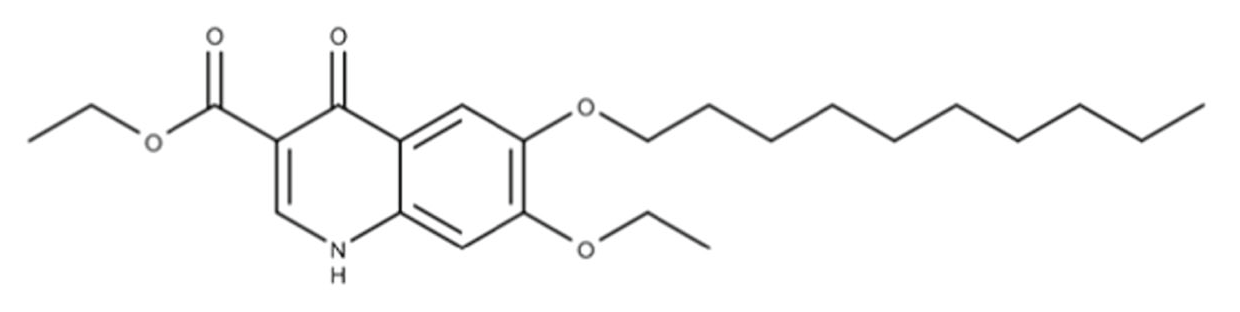
متیل بنزوکوئینات
استر آلکوکسی کینولون بوده و در کنترل کوکسیدیوز با کلوپیدول خاصیت همافزایی دارد. خواص و ساز و کار عمل متیل بنزوکوئینات مشابه با دکوکوئینات بوده و استفاده از آن در کنترل بیماری کوکسیدیوز منسوخ شده است.
باکینولات
این دارو واجد اثرات وسیع کنترل کننده روی انواع ایمریا است. باکینولات موجب توقف فعالیت زیستی اسپروزوئیت ایمریا شده اما آن را نمیکشد. دز متداول باکینولات ۰.۰۰۸۲۵ درصد در خوراک است. سمیت باکینولات بسیار اندک بوده و پس از قطع مصرف، با سرعت زیاد از بافتهای بدن تخلیه میشود.
نیکاربازین
نیکاربازین ترکیبی از دو ملکول ۲-هیدروکسی-۴,۶-دی متیل پریمیدین یا به اختصار HPD و ۴,’۴-دی نیتروکربانیلاید یا به اختصار DNC با مولاریته یکسان است. ترکیب HPD در مقایسه با DNC با سرعت کمتر از روده جذب میشود اما ماندگاری آن در بافت بالاتر است و همین شیوه عمل دوگانه از مهمترین ویژگیهای کوکسیدیوستات نیکاربازین است.
نیکاربازین که استفاده از آن به عنوان کوکسیدیوستات از سال ۱۹۵۵ رایج شده، از دامنه وسیع فعالیت علیه انواع ایمریا برخوردار بوده و بیشترین اثر آن علیه شیزونتهایی است که پس از نسل اول تقسیم سلولی ایمریا پدید میآیند. اثر ثانویه این ترکیب، جلوگیری از تولید مثل جنسی تک یاختههای عامل بیماری کوکسیدیوز است. نیکاربازین معمولا در قالب پرمیکس ۲۲.۵ درصد در بازار موجود بوده که پس از ترکیب با خوراک با غلظت ۰.۰۱۲۵ درصد وارد بدن پرنده میشود. نیکاربازین پس از ورود به درون سلول انگل، سبب توقف تولید ATP در سیتوپلاسم کوکسیدیا شده و بدین ترتیب تامین انرژی برای فرآیندهای سلولی از جمله پمپ سدیم – پتاسیم مختل میشود. به دنبال از کار افتادن پمپ سدیم – پتاسیم در غشا سلولی، سدیم مازاد از سلول خارج نشده و به دنبال آن آب وارد سلول شده که در نهایت موجب تورم و متلاشی شدن کوکسیدیا میشود. این شکل از عمل علیه کوکسیدیا سبب شده تا در شرایط بروز مقاومت نسبت به دیگر داروها، نیکاربازین همچنان با موفقیت کامل عمل کند.
کوکسیدیوستات نیکاربازین معمولا فقط برای جوجه گوشتی استفاده میشود و مصرف آن در طیور تخمگذار باعث کاهش تولید تخم مرغ و میزان باروری آنها میشود. نیکاربازین همچنین سبب دپیگمانتاسیون (از بین رفتن رنگدانه) در تخم مرغ قهوهای و لکهدار شدن و وارفتگی زرده میشود. در جوجه گوشتی توصیه بر این است تا حداقل چهار روز پیش از کشتار، نیکاربازین از جیره حذف شود. در خصوص مسمومیت طیور با نیکاربازین، مطلب مسمومیت در طیور را بخوانید.
مصرف نیکاربازین از آنجایی که تعادل الکترولیتی و آب را دربدن پرنده دچار چالش میکند، در شرایط تنش گرمایی گزینه مطلوبی نبوده و موجب افزایش قابل توجه تلفات، افت عملکرد و تلفات میشود. استفاده از نیکاربازین در دو هفته اول زندگی جوجه گوشتی و پس از آن ادامه مسیر با ترکیبات یونوفره از استراتژیهای متداول در کنترل کوکسیدیوز در آمریکا طی فصل زمستان محسوب میشود. نیکاربازین دارای اثرات همافزایی با ناراسین بوده و داروهای ترکیبی آنها با اثربخشی بالا به بازار عرضه شده است.
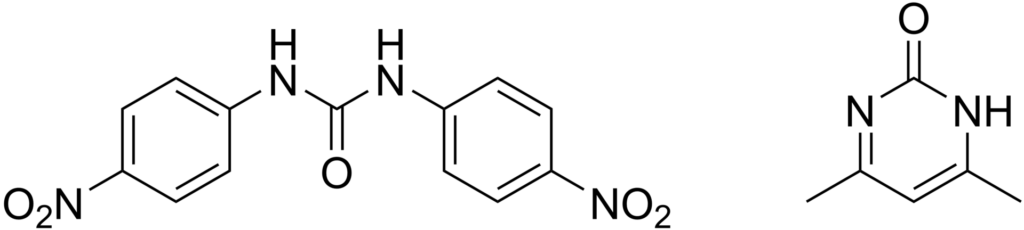
آمپرولیوم
ساختار شیمیایی کوکسیدیوستات آمپرولیوم در تصویر زیر ارائه شده است. این ترکیب شیمیایی به دلیل شباهت ساختمانی، آنتاگونیست تیامین (ویتامین B1) محسوب میشود و حضور آن مانع از تشکیل تیامین پیروفسفات به عنوان پیشنیاز بسیاری از واکنشهای ضروری در سلول میشود. آمپرولیوم از بیشترین اثرگذاری بر گونههای تنلا، نکاتریکس، آسرولینا و در درجه بعدی روی ایمریا ماکسیما برخوردار است. به همین دلیل آمپرولیوم اغلب با همراه با ترکیبات آنتاگونیست اسید فولیک (فولاسین) مانند سولفانامیدها به ویژه سولفاکوئینوکسالین، اتوپابات و حتی پریمتامین (Pyrimethamine) عرضه میشود تا به بهترین نتیجه از نظر کنترل کوکسیدیوز منتهی شود. آمپرولیوم از جمله داروهایی است که امکان مصرف آن به دفعات بدون بازخورد منفی روی گله مقدور است.
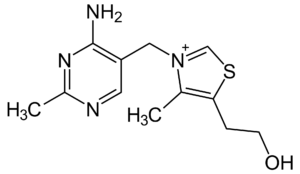
بیشترین اثرگذاری این ترکیب روی شیزونت ها و نسل اول تروفوزوئیت ها بوده و اوج فعالیت آن در روز سوم چرخه حیات کوکسیویوز مشاهده می شود. آمپرولیوم همچنین سبب اختلال در فرآیند تولید مثل جنسی کوکسیدیا، گامتوگونی و تولید اسپور اووسیت می گردد.
طی سالیان اخیر به دلیل استفاده بیش از حد از آمپرولیوم، بروز مقاومت دارویی نسبت به آن گزارش شده است. همچنین به دلیل اثرگذاری ضعیف آمپرولیوم بر ایمریا ماکسیما و برخی گونههای دیگر ایمریا، به ندرت به تنهایی مصرف میشود. در صورتی که استفاده از آمپرولیوم به تنهایی باشد، اغلب در دز ۰.۰۱۲۵ درصد پیشنهاد میشود و اگر در کنار داروی دیگری استفاده گردد، معمولا از نصف این دز استفاده میشود. ترکیب آمپرولیوم با سولفاکوئینوکسالین (هر یک به میزان ۰.۰۰۶ درصد) اغلب منجر به کسب بهترین نتیجه در کنترل کوکسیدیوز میشود. آمپرولیوم تنها داروی تایید شده جهت استفاده در مرغان تخمگذار تجاری حین تولید تخم مرغ به منظور پیشگیری و درمان کوکسیدیوز است.
باید توجه داشت که آمپرولیوم با شدتهای مختلف، آنتاگونیست ترکیبات فعال در خوراک طیور به ویژه تیامین محسوب میشود و احتمال بروز کمبود تیامین در حیوان میزبان محتمل است. افزودن تیامین به خوراک پرنده میتواند از بروز احتمالی کمبود پیشگیری کند. از طرفی استفاده از آن در جیرههای حاوی سطوح بالای کولین میتواند منجر به تولید اسید پیکریک شود که ترکیبی سمی بوده و ممکن است موجب تلفات و افت عملکرد گله شود.
آمپرولیوم با فورازولیدون تداخل داشته و نباید به طور همزمان مصرف شود و همچنین به دمای پخت (پلت کردن) و تغییرات اسیدیته خوراک حساس بوده و تخریب میشود.
اتوپابات
اتوپابات از نظر ساختمانی آریل آمید حاوی یک حلقه فنیل است و جزو ایمن ترین داروهای ضدکوکسیدیوز به حساب می آید. اتوپابات روی همه گونههای ایمریا به جز انواع سکومی موثر است. مکانیسم اثر اتوپابات، رقابت با PABA برای جذب توسط ایمریا است و به همین دلیل موجب اختلال در ساخت اسید فولیک توسط انگل میشود و اوج فعالیت آن در چهارمین روز چرخه زندگی انگل به حداکثر خود میرسد. این دارو روی ایمریا آسرولینا و برخی سویههای ماکسیما و برونتی بسیار موفق عمل میکند. این دارو در بعد تجاری به دلیل عدم تاثیرگذاری بر ایمریا تنلا، صرفا همراه با آمپرولیوم عرضه شده و اغلب از دز چهار پی پی ام اتوپابات و ۴۰ پی پی ام آمپرولیوم استفاده میشود. این دارو نیاز به قطع مصرف پیش از کشتار ندارد.
کلوپیدول (کلوپیندول)
کلوپیدول یا کلوپیندول تنها ترکیب کوکسیدیوستات از خانواده پریدینولها است که اثرات قابل قبولی در کنترل این بیماری داشته است. کلوپیدول روی مراحل اسپروزوئیت و تروفوزوئیت ایمریا موثر بوده و مانع تنفس سلولی انگل میشود. طبق تحقیقات انجام شده، کلوپیدول از بیشترین اثر نابودکنندگی روی اسپور کوکسیدیوز در بین داروهای رایج برخوردار است و بنابراین عملکرد مطلوب آن تنها زمانی است که پیش از آلودگی گله به کوکسیدیوز، وارد جیره غذایی گله شده باشد. بر این اساس در صورت انتخاب کلوپیدول به عنوان کوکسیدیوستات، باید از روز اول زندگی جوجه وارد خوراک شود. کلوپیدول مانع از فعال شدن اسپور ایمریا در اپیتلیوم روده میزبان می شود و به همین دلیل به محض قطع شدن دارو، علائم درگیری بروز پیدا می کند.
کلوپیدول معمولا با دز ۱۲۵ پی پی ام در خوراک استفاده می شود و نیازی به قطع مصرف آن پیش از کشتار نیست. کلوپیدول با فورازولیدون تداخل داشته و نباید به طور همزمان مصرف شود.
روبنیدین
روبنیدین از مشتقات مصنوعی گوانیدین بوده و در آمریکا برخلاف اروپا و آمریکای جنوبی به ندرت استفاده میشود. روبنیدین بر مراحل اولیه توسعه درون سلولی کوکسیدیا موٍثر نبوده اما به دلیل داشتن اثر بازدارندگی روی فسفریلاسیون اکسیداتیو سلول ایمریا، موجب اختلال در چرخه حیات و مرگ شیزونتهای نسل اول و دوم میشود.

هالوفوگینون
هالوفوگینون (Halofuginone) از مشتقات کوئینازولینون بوده و در واقع ترکیبی آلکالوئیدی با منشا گیاهی است. اولین کاربرد هالوفوگینون به عنوان داروی ضد مالاریا در چین بوده است. این دارو به عنوان یک ترکیب کوکسیدیوستات و نیز کوکسیدیوسیدال از عملکرد مطلوب برخوردار است و بیشترین اثر آن روی نسل اول و دوم شیزونت است. مکانیسم اثر هالوفوگینون در کنترل کوکسیدیوز نامشخص است.
این دارو در مقدار سه پی پی ام در خوراک توصیه میشود و در مرغ تخمگذار مصرف نمیشود. آنتی بیوتیک فلاوومایسین با هالوفوگینون اثرات همافزایی داشته و یکدیگر را تقویت میکنند. دوره پرهیز از مصرف هالوفوگینون برای جوجه گوشتی حداقل پنج روز و برای بوقلمون حداقل هفت روز است. هالوفوگینون برای آبزیان به شدت سمی است.
دیکلازوریل
دیکلازوریل همچون تولترازوریل ترکیبی متعلق به کوکسیدیوستاتهای شیمیایی بوده و از گروه تری آزینها (ترکیبات ناجور حلقه حاوی نیتروژن) و مشتق از بنزن استونیترایل است. این کوکسیدیوستات در واقع یک ترکیب آنالوگ نوکلئوزید است و موجب اختلال در ساخت اسیدهای نوکلئیک میشود و به نظر میرسد دیکلازوریل بیشترین تاثیر را بر مراحل نهایی تکامل کوکسیدیا دارد. دیکلازوریل با مهار کلیه مراحل جنسی و غیرجنسی حیات کوکسیدیا از طریق متوقف سازی تقسیم سلولی شیزونت و مهار ساخت دیواره میکروگامت عمل میکند و روی تمام گونههای ایمریا موثر است. دیکلازوریل با تاثیر بر فرآیند ساخت دیواره انگل، سبب عدم توسعه یکنواخت و ضخامت غیرطبیعی آن میشود. همچنین دیکلازوریل موجب کاهش قابل توجه ساخت mRNA سرین/ترئونین پروتئین فسفات تیپ ۵ (PP5) در سلول ایمریا به عنوان یکی از پروتئینهای تنظیمگر مهم در یوکاریوتها میشود. با این حال مکانیسم عمل دقیق دیکلازوریل مشخص نیست و این تغییرات ممکن است تنها عواقب ناشی از فعال شدن مکانیسم عمل اصلی باشند.
دیکلازوریل در خوراک و معمولا به میزان یک پی پی ام مورد استفاده قرار میگیرد.
تولترازوریل
تولترازوریل ترکیبی مشابه دیکلازوریل بوده و عمدتا در آب آشامیدنی استفاده می شود. این دارو مشابه دیکلازوریل روی اغلب گونه های ایمریا موثر بوده و به ویژه از عملکرد بسیار خوبی روی ایمریا تنلا برخوردار است. تولترازوریل باعث اختلال در بیوسنتز پریمیدین میتوکندریایی شده و به این ترتیب چرخه تنفس انگل را متوقف میکند. این ترکیب همچنین بر ارگانلهای شبه پلاستید تاثیر میگذارد. تولترازوریل که یک ناجور حلقه حاوی نیتروژن است، یکی از تریآزینهای موثر بر مراحل درون سلولی شیزوگونی و گاموگونی بوده و بیشترین تاثیر خود را بر میتوکندری و شبکه آندوپلاسمی انگل وارد میکند. آنزیمهای تنفس سلولی مانند سوکسینات سیتوکروم C ردوکتاز، NADH اکسیداز و فومارات ردوکتاز به همراه آنزیمهای دخیل در سنتز پریمیدین توسط تولترازوریل متوقف میشوند.




1 دیدگاه دربارهٔ «درمان دارویی کوکسیدیوز»
ممنون از مقاله خوبتون